GPNMB作用机制图
山东第一医科大学附属皮肤病医院张福仁/刘红课题组,揭示了感染过程中,GPNMB通过阻断SNARE复合体组装,促进胞内菌在巨噬细胞中存活增殖的新机制。相关成果以“GPNMB通过阻断SNARE复合体组装来维持巨噬细胞内的细菌增殖(GPNMB disrupts SNARE complex assembly to maintain bacterial proliferation within macrophages)”为题,2025年3月4日发表于《细胞与分子免疫学》(Cellular&Molecular Immunology)杂志,论文链接:https://www.nature.com/articles/s41423-025-01272-z。
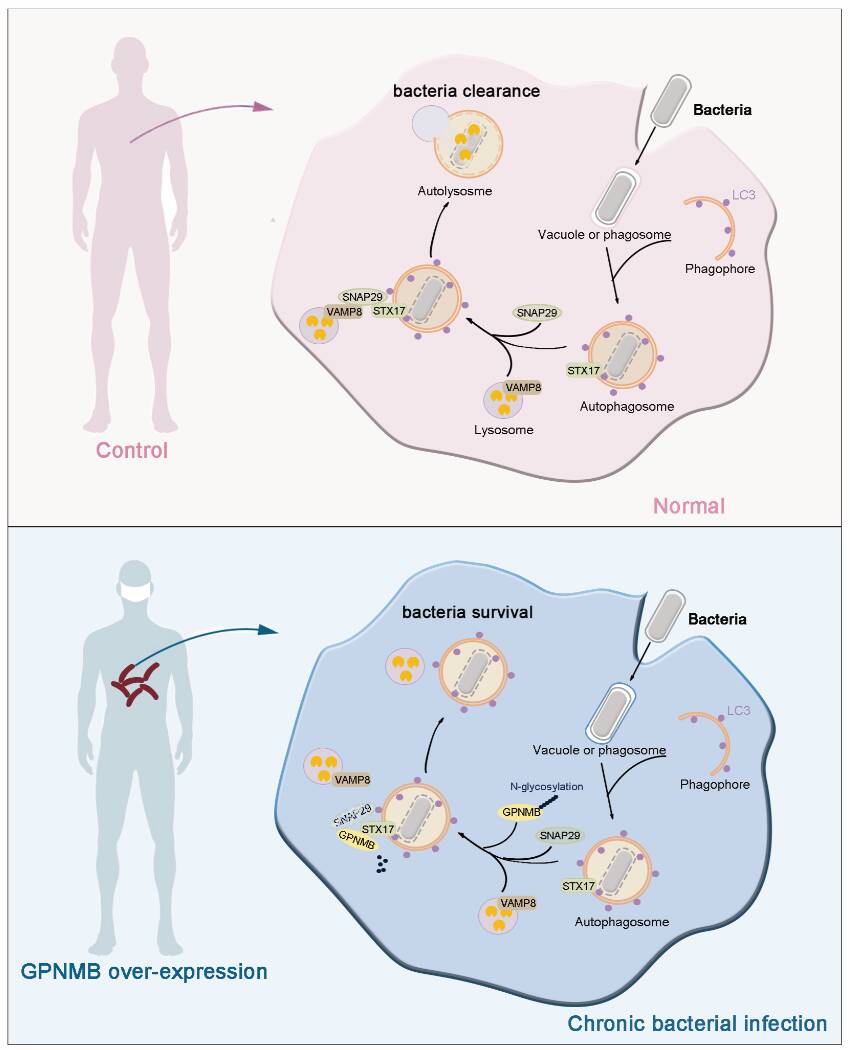
异源自噬(Xenophagy)在抑制巨噬细胞内细菌增殖中发挥着关键作用,但在细菌感染中自噬体与溶酶体融合的调控机制尚未完全明确。麻风是一个典型的胞内菌感染性疾病,一直被认为是研究宿主防御机制与细菌感染之间相互作用的理想疾病模型。课题组前期研究发现GPNMB基因(eBiomedicine,2024)在瘤型麻风(L-Lep)的巨噬细胞中高表达,提示其与麻风分枝杆菌的免疫逃逸相关,但具体机制不清。
本研究以麻风为模型,首次系统揭示了GPNMB在宿主抗菌防御中的新功能。研究发现细菌感染后,GPNMB被招募到自噬小体,并与自噬小体定位蛋白STX17结合,致其N296位点N-糖基化水平降低,进而促进SNAP29蛋白降解,阻断STX17-SNAP29-VAMP8 SNARE复合体组装;上述过程直接破坏了自噬体与溶酶体的融合过程,抑制了细胞的自噬流,最终削弱了宿主对胞内细菌的清除能力。除麻风分枝杆菌外,GPNMB缺陷还可显著抑制多种胞内病原体(如海分枝杆菌、李斯特菌、沙门氏菌)在巨噬细胞内的增殖,提示其在胞内菌感染中的普遍调控作用。利用小鼠感染模型研究发现,与野生型相比,Gpnmbfl/fl Lyz2-Cre小鼠体内海分枝杆菌载量显著降低,进一步从体内实验证实了GPNMB在胞内菌感染中的意义。
该研究首次阐明了GPNMB通过调控SNARE复合体组装影响宿主杀菌的分子机制,为靶向自噬通路的抗感染治疗提供了新思路。
本研究得到国家自然科学基金、山东省自然科学基金、山东省泰山学者项目和山东第一医科大学(山东省医学科学院)临床-基础联合创新团队项目支持。